Bactérias que se alimentam de metano convertem gás de efeito estufa em combustível.
Ao estudar a enzima que as bactérias usam para catalisar a reação, uma equipe da Northwestern University descobriu estruturas-chave que podem conduzir o processo.
Suas descobertas, a serem publicadas sexta-feira (18 de março) na revista Science , podem levar ao desenvolvimento de catalisadores biológicos feitos pelo homem que convertem o gás metano em metanol.
“O metano tem uma ligação muito forte, por isso é bastante notável que haja uma enzima que possa fazer isso”, disse Amy Rosenzweig, da Northwestern, autora sênior do artigo. “Se não entendermos exatamente como a enzima realiza essa química difícil, não seremos capazes de projetá-la e otimizá-la para aplicações biotecnológicas.”
Rosenzweig é a Weinberg Family Distinguished Professor of Life Sciences na Weinberg College of Arts and Sciences da Northwestern, onde ela ocupa cargos em biociências moleculares e química.
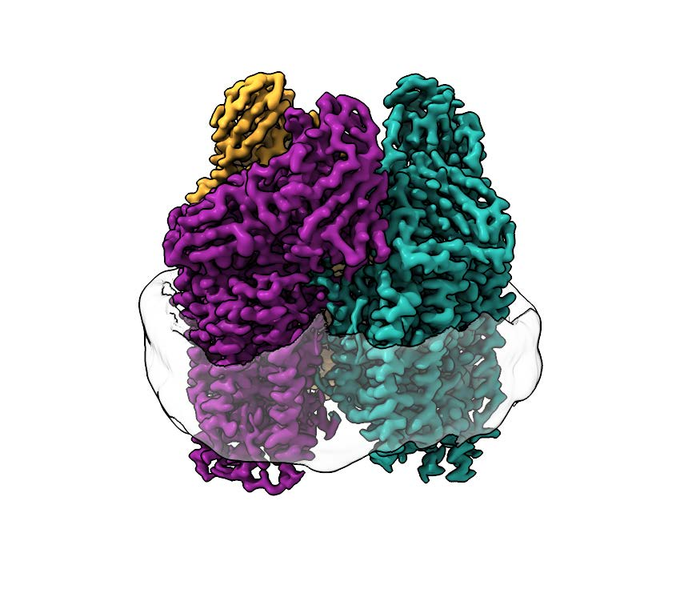
A enzima, chamada monooxigenase de metano particulado (pMMO), é uma proteína particularmente difícil de estudar porque está incorporada na membrana celular da bactéria.
Normalmente, quando os pesquisadores estudam essas bactérias metanotróficas, eles usam um processo severo no qual as proteínas são arrancadas das membranas celulares usando uma solução detergente. Embora esse procedimento isole efetivamente a enzima, ele também mata toda a atividade enzimática e limita a quantidade de informações que os pesquisadores podem coletar – como monitorar um coração sem batimentos cardíacos.
Neste estudo, a equipe usou uma técnica inteiramente nova. Christopher Koo, o primeiro autor e Ph.D. candidato no laboratório de Rosenzweig, se perguntou se, colocando a enzima de volta em uma membrana que se assemelha ao seu ambiente nativo, eles poderiam aprender algo novo. Koo usou lipídios das bactérias para formar uma membrana dentro de uma partícula protetora chamada nanodisco e, em seguida, incorporou a enzima nessa membrana.
“Ao recriar o ambiente nativo da enzima dentro do nanodisco, conseguimos restaurar a atividade da enzima”, disse Koo. “Então, fomos capazes de usar técnicas estruturais para determinar no nível atômico como a bicamada lipídica restaurou a atividade. Ao fazer isso, descobrimos o arranjo completo do local do cobre na enzima onde a oxidação do metano provavelmente ocorre.”
Os pesquisadores usaram microscopia crioeletrônica (crio-EM), uma técnica bem adequada para proteínas de membrana porque o ambiente da membrana lipídica não é perturbado durante todo o experimento. Isso permitiu que eles visualizassem a estrutura atômica da enzima ativa em alta resolução pela primeira vez.
“Como consequência da recente ‘revolução de resolução’ em crio-EM, pudemos ver a estrutura em detalhes atômicos”, disse Rosenzweig. “O que vimos mudou completamente a maneira como pensávamos sobre o sítio ativo dessa enzima”.
Rosenzweig disse que as estruturas crio-EM fornecem um novo ponto de partida para responder às perguntas que continuam a se acumular. Como o metano viaja para o sítio ativo da enzima? Ou o metanol sai da enzima? Como o cobre no sítio ativo faz a reação química? Em seguida, a equipe planeja estudar a enzima diretamente dentro da célula bacteriana usando uma técnica de imagem de vanguarda chamada tomografia crioeletrônica (crio-ET).
Se for bem-sucedido, os pesquisadores poderão ver exatamente como a enzima está organizada na membrana celular, determinar como ela opera em seu ambiente verdadeiramente nativo e saber se outras proteínas ao redor da enzima interagem com ela. Essas descobertas forneceriam um elo chave que faltava para os engenheiros.
“Se você deseja otimizar a enzima para conectá-la a vias de biofabricação ou consumir outros poluentes além do metano, precisamos saber como ela se parece em seu ambiente nativo e onde o metano se liga”, disse Rosenzweig. “Você pode usar bactérias com uma enzima projetada para coletar metano de locais de fraturamento ou para limpar derramamentos de óleo”.
O estudo, “Recuperação da estrutura e atividade particulate de metano monooxigenase em uma bicamada lipídica”, foi apoiado pelos Institutos Nacionais de Saúde (números de concessão R35GM118035, T32GM008382, T32GM105538 e R01GM135651).